

肥胖已经成为公认的全球性健康问题,是心血管疾病的重要危险因素。在肥胖状态下,脂肪组织发生异常重塑而导致功能稳态失衡,引发血脂紊乱,加速动脉粥样硬化的发生【1】。脂肪组织异常重塑会引起局部组织缺氧【2】,进而诱导脂肪组织发生炎症和纤维化,加速肥胖诱导的胰岛素抵抗的发生【3,4】。
William G. Kaelin 教授、Peter J. Ratcliffe教授和Gregg L. Semenza教授揭示了细胞感知和适应氧气供应机制,以此获得2019年诺贝尔生理学或医学奖(深度梳理丨详解氧感知通路的研究历程——致2019年诺贝尔生理或医学奖)。作为氧感知及应答的关键效应分子,缺氧诱导因子(HIF)在调节脂肪细胞功能及机体能量代谢中发挥重要作用【5】。已有研究证实脂肪细胞HIF1α促进脂肪组织纤维化和炎症反应,加重高脂饮食诱导的肥胖和胰岛素抵抗【6-8】;而脂肪细胞HIF2α可拮抗HIF1α的作用,改善肥胖和胰岛素抵抗【9】。但截止到目前,二者在肥胖诱导的动脉粥样硬化中所起的作用却未有报道。
2019年10月24日,美高梅登录正网基础医学院生理学与病理生理学系的姜长涛与王宪教授团队在Cell Metabolism在线发表了题为“Adipocyte hypoxia-inducible factor 2α suppresses atherosclerosis by promoting adipose ceramide catabolism”的研究论文,发现脂肪细胞HIF2α通过促进神经酰胺分解改善动脉粥样硬化,提示脂肪细胞HIF2α可以作为干预动脉粥样硬化的新靶点。

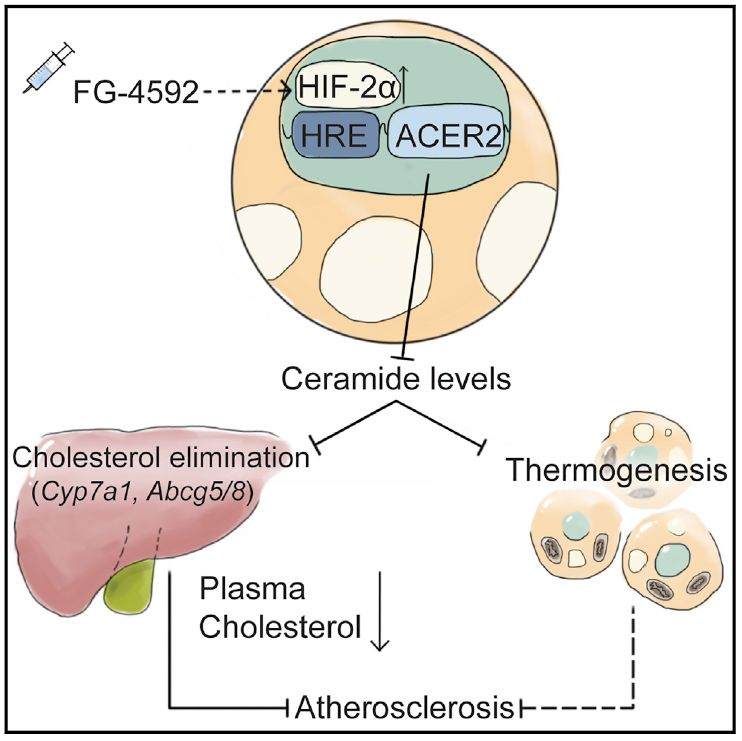
已有研究证实,低温通过调节脂肪组织功能改善动脉粥样硬化【10,11】。研究人员探寻其潜在的保护机制,发现低温(16°C)明显上调脂肪HIF2α表达,而不影响HIF1α。在动脉粥样硬化小鼠模型上,研究者发现在低温(16°C)或者室温条件下,小鼠脂肪细胞特异的HIF2α敲除加重西式饮食诱导的动脉粥样硬化,提示其为介导脂肪—血管对话的关键分子。研究团队进一步探究脂肪HIF2α调控动脉粥样硬化的代谢机制,利用代谢组学技术检测脂肪和血浆中的脂质代谢物水平,发现脂肪细胞特异敲除HIF2α可引起脂肪与血浆中神经酰胺蓄积,抑制肝脏胆固醇清除,从而增加血浆中胆固醇水平,以及加重血管局部炎症。进一步的RNA-Seq、ChIP及荧光素酶报告基因等实验证实神经酰胺分解酶Acer2是脂肪细胞HIF2α的新型靶基因,给予脂肪细胞特异敲除HIF2α小鼠的内脏脂肪回补Acer2可以促进神经酰胺分解,降低脂肪与血浆中的神经酰胺水平,减轻其对肝脏胆固醇外流的抑制,从而改善动脉粥样硬化。
FG-4592(罗沙司他)是首个开发的缺氧诱导因子脯氨酰羟化酶抑制剂(HIF—PHI)类治疗慢性肾性贫血的新药。已有临床研究标明,服用FG-4592的患者血浆胆固醇水平显著降低。该团队证实FG-4592可激活脂肪组织HIF2α,减少脂肪组织与血浆神经酰胺,降低血浆胆固醇水平与血管局部炎症,减轻动脉粥样硬化;而脂肪细胞特异的HIF2α敲除则能够明显阻断FG-4592对动脉粥样硬化的保护作用。
该研究揭示了脂肪细胞HIF2α通过促进脂质介质神经酰胺分解改善动脉粥样硬化的代谢机制,发现FG-4592可通过激活脂肪细胞HIF2α减轻动脉粥样硬化的潜在作用,为干预动脉粥样硬化提供了新的分子靶点与潜在药物。
美高梅登录正网基础医学院姜长涛研究员为本文通讯作者。
原文链接:
https://doi.org/10.1016/j.cmet.2019.09.016
参考文献
1. Fuster, J.J., Ouchi, N., Gokce, N. & Walsh, K. Obesity-Induced Changes in Adipose Tissue Microenvironment and Their Impact on Cardiovascular Disease. Circulation research 118, 1786-1807 (2016).
2. Pasarica, M., et al. Reduced adipose tissue oxygenation in human obesity: evidence for rarefaction, macrophage chemotaxis, and inflammation without an angiogenic response. Diabetes 58, 718-725 (2009).
3. Regazzetti, C., et al. Hypoxia decreases insulin signaling pathways in adipocytes. Diabetes 58, 95-103 (2009).
4. Lee, Y.S., et al. Increased adipocyte O2 consumption triggers HIF-1alpha, causing inflammation and insulin resistance in obesity. Cell 157, 1339-1352 (2014).
5. Gonzalez, F.J., Xie, C. & Jiang, C. The role of hypoxia-inducible factors in metabolic diseases. Nature Reviews Endocrinology 15, 21-32 (2019).
6. Jiang, C., et al. Disruption of Hypoxia-Inducible Factor 1 in Adipocytes Improves Insulin Sensitivity and Decreases Adiposity in High-Fat Diet–Fed Mice. Diabetes 60, 2484-2495 (2011).
7. Halberg, N., et al. Hypoxia-inducible factor 1alpha induces fibrosis and insulin resistance in white adipose tissue. Molecular & Cellular Biology 29, 4467-4483 (2009).
8. Sun, K., Halberg, N., Khan, M., Magalang, U.J. & Scherer, P.E. Selective inhibition of hypoxia-inducible factor 1α ameliorates adipose tissue dysfunction. Molecular & Cellular Biology 33, 904-917 (2013).
9. Garcia-Martin, R., et al. Adipocyte-Specific Hypoxia-Inducible Factor 2alpha Deficiency Exacerbates Obesity-Induced Brown Adipose Tissue Dysfunction and Metabolic Dysregulation. Molecular and cellular biology 36, 376-393 (2015).
10. Chang, L., et al. Loss of perivascular adipose tissue on peroxisome proliferator-activated receptor-gamma deletion in smooth muscle cells impairs intravascular thermoregulation and enhances atherosclerosis. Circulation 126, 1067-1078 (2012).
11. Xiong, W., et al. Brown Adipocyte-Specific PPARgamma (Peroxisome Proliferator-Activated Receptor gamma) Deletion Impairs Perivascular Adipose Tissue Development and Enhances Atherosclerosis in Mice. Arteriosclerosis, thrombosis, and vascular biology 38, 1738-1747 (2018).