

2022年12月,美高梅登录正网基础医学院彭宜红教授课题组在国际病毒学期刊《Journal of Medical Virology》在线发表题为“Phosphorylation of Enteroviral 2Apro at Ser/Thr125 Benefits Its Proteolytic Activity and Viral Pathogenesis”的研究论文,阐明了肠道病毒2A蛋白Ser/Thr125磷酸化有益于病毒的复制及致病性,揭示了肠道病毒宿主适应性的新机制。

肠道病毒(enteroviruses, EV)是人类新发和高发传染病的重要病原,但针对大多数EVs感染,目前尚无有效疫苗和抗病毒药物。自上个世纪90年代起,肠道病毒2A蛋白酶(2Apro)就被发现在病毒的复制和致病中具有重要作用,但其执行重要功能过程中的调控机制并不完全清楚。揭示相关机制,对于深入认识肠道病毒基本规律并建立有效的肠道病毒防控策略,具有重要的理论意义和广泛的社会需求。
彭宜红教授课题组前期工作表明,宿主细胞ERK激酶通过增强肠道病毒2Apro对真核细胞翻译起始因子4G(eIF4G)的切割活性,上调病毒IRES依赖的蛋白翻译,促进病毒增殖,提示肠道病毒2Apro可能存在具有重要功能的磷酸化机制。
本研究发现:①EV 2Apro存在丝/苏氨酸磷酸化。选用重要的肠道病毒EV-A71和CVB3为代表株,通过构建2Apro的酶活性中心催化三联体His-Asp-Cys突变的蛋白表达质粒(EV-A71 2Am和CVB3 2Am)、一系列2Am单个潜在磷酸化位点突变质粒,用His-pull down和泛磷酸化丝/苏氨酸抗体证明,EV-A71 2 Am蛋白发生了S125磷酸化,而CVB3 2 Am蛋白存在T125磷酸化。②丝/苏氨酸磷酸化受细胞ERK激酶调控。进一步特异性阻断ERK激酶活性,可观察到2 Am S/T125磷酸化水平被明显抑制;激光共聚焦结果显示磷酸化ERK1/2分别与这两种2 Am蛋白存在共定位作用;此外,in vitro磷酸化实验结果显示,激活的ERK2激酶可介导EV-A71 2 Am和CVB3 2 Am S/T125体外磷酸化修饰。
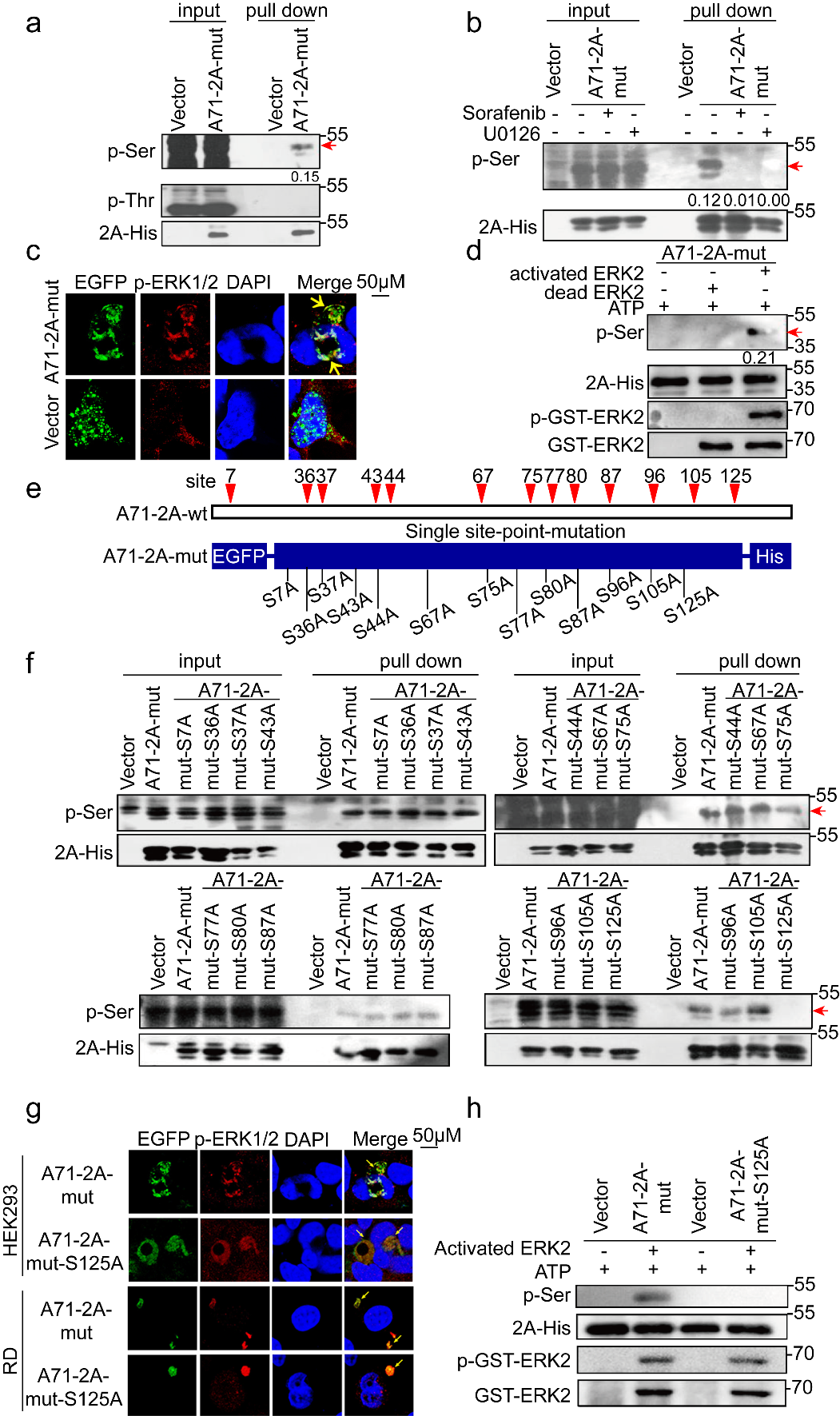
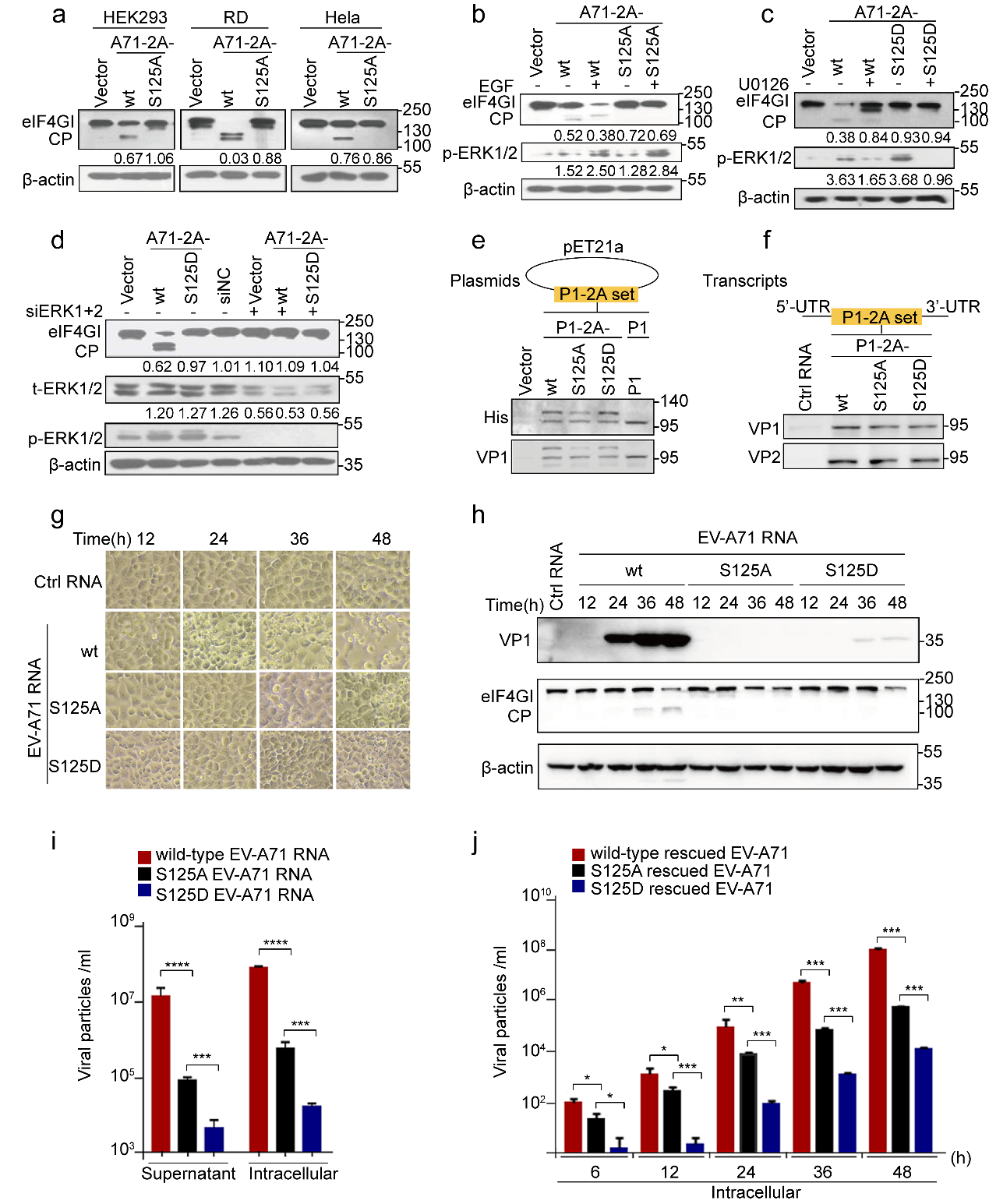
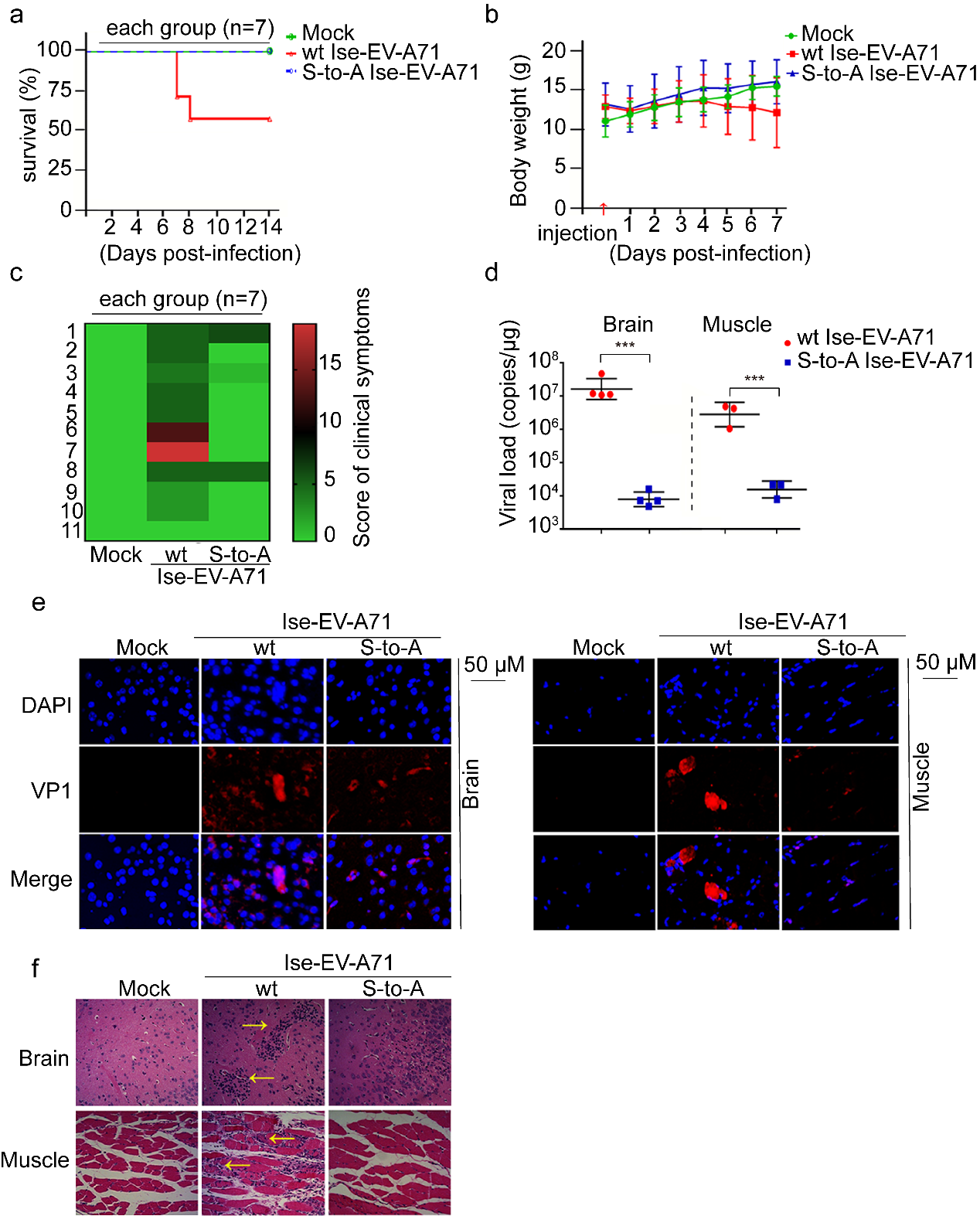
③模拟非磷酸化的S/T 125A,2Apro的酶活性、病毒的复制和致病性显著减弱,且该现象在肠道病毒属病毒中高度保守。采用经典的突变体功能实验表明,模拟非磷酸化的S/T 125A 2Apro对细胞eIF4G切割能力明显减弱;同样,S/T 125A病毒引起的CPE显著减弱,病毒载量下降100倍。用S125A EV-A71感染hSCARB2-KI鼠,发现小鼠的生存曲线、体重变化、临床症状、组织学病理表现和病毒载量等代表病毒增殖和致病能力的指标,与野生型病毒感染的hSCARB2-KI鼠相比显著减弱。此外,序列比对以及5种(species)代表性EV 2A S/T125A蛋白功能实验发现,S/T 125磷酸化及其功能在整个肠道病毒属的2Apro中高度保守。
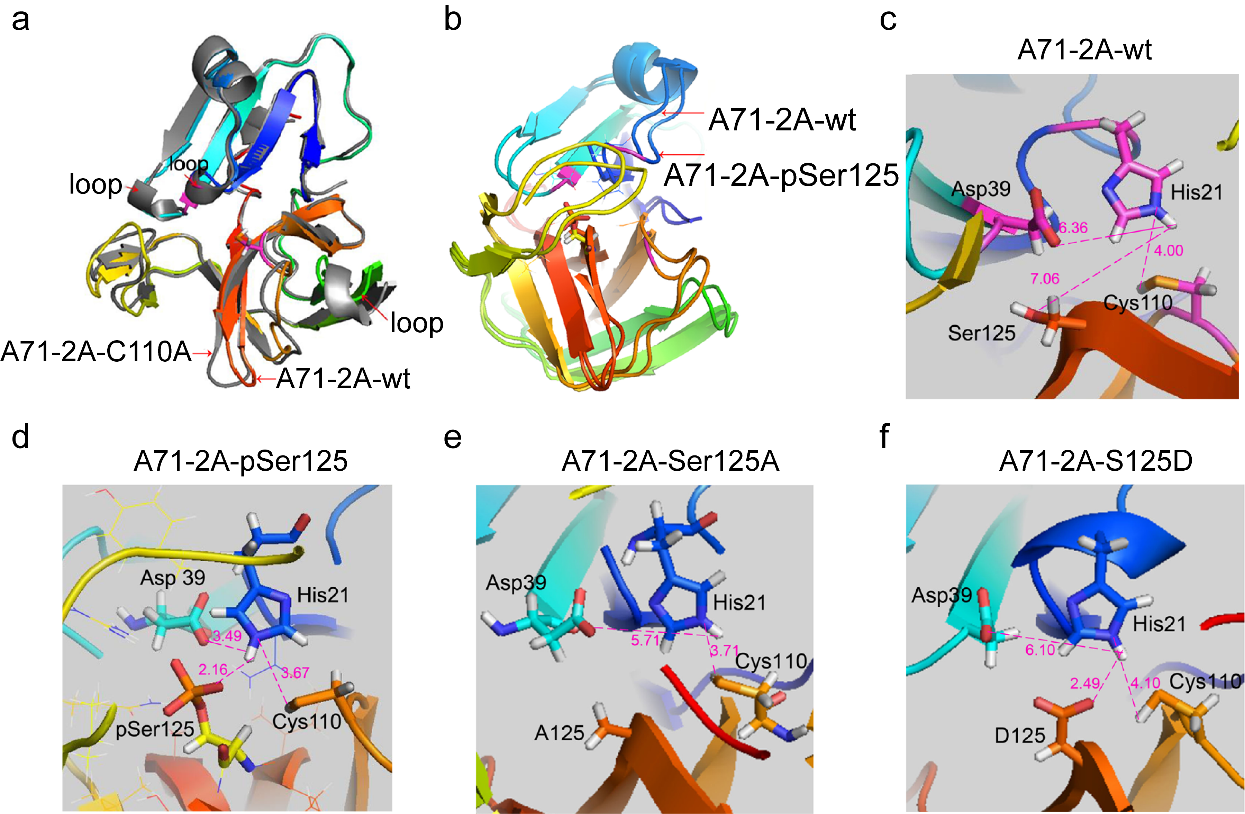
④基于EV-A71 2A pro 3D晶体结构的分子动力学分析发现,S125磷酸基团可与周围氨基酸残基形成有效的氢键网络,从而改变2A活性中心催化三联体His-Asp-Cys空间构象,有利于Cys的-SH执行水解底物功能。而S125A和S125D基团均不具有形成有效氢键网络的作用。由此揭示了EV-A71 2Apro S125 磷酸化修饰有益于对底物水解的分子动力学机制。
综上,本研究确立:肠道病毒存在由宿主细胞ERK1/2激酶介导的2Apro S/T125单位点磷酸化修饰作用,该位点磷酸化有益于病毒 2Apro切割活性,并有效保障肠道病毒增殖和致病作用,且该作用在肠道病毒中高度保守,体现了肠道病毒对宿主细胞的适应性。其机制是通过2A 125位点的磷酸化,来改变催化三联体His-Asp-Cys空间构象,能有效保障其执行Cys -SH底物的水解作用。此外,含有S/T125A突变的弱毒株为开发肠病毒减毒活疫苗提供了潜在的通用策略,该工作已获得国家发明专利1项(专利号:ZL 2020 1 0026635.4)。
美高梅登录正网基础医学院彭宜红教授为本论文的通讯作者,基础医学院博士生王誉雅、博士研究生邹文佳为本文的共同第一作者。美高梅登录正网基础医学院为第一完成单位。美高梅登录正网药学院教授徐萍教授和牛彦副教授,中国食品药品检定研究院范昌发研究员和吴勇技师,哈尔滨医科大学钟照华教授,南昌大学罗志军教授为本论文的共同作者,并为研究工作的顺利完成提供了重要支持和帮助。本研究得到了国家自然科学基金(No. 81974310 and No.81772184)、国家重点研发计划项目的资助(No. 2021YF2301700)。
(基础医学院)