

天然产物一直是药物发现的重要来源,但由于很多天然产物天然含量低、分离提取困难等因素限制了其后续的活性研究,因此,如何实现微量活性天然产物的高效合成一直是亟待解决的重要科学问题。近年来,随着科学家对天然产物全合成领域越来越重视,很多天然产物的全合成得以实现。
2022年2月15日和22日,美高梅登录正网药学院贾彦兴教授团队在国际著名期刊《德国应用化学》(Angew. Chem. Int. Ed.)连续报告了在天然产物全合成领域的最新研究进展:成果一、“Bioinspired Total Synthesis of (+)-Euphorikanin A”(生源合成途径启发的天然产物(+)-euphorikanin A的全合成);成果二、“Divergent Total Synthesis of Four Kopsane Alkaloids: N-Carbomethoxy-10,22-dioxokopsane, Epikopsanol-10-lactam, 10,22-Dioxokopsane, and N-Methylkopsanone”(四个kopsane家族天然产物的多样性全合成)。
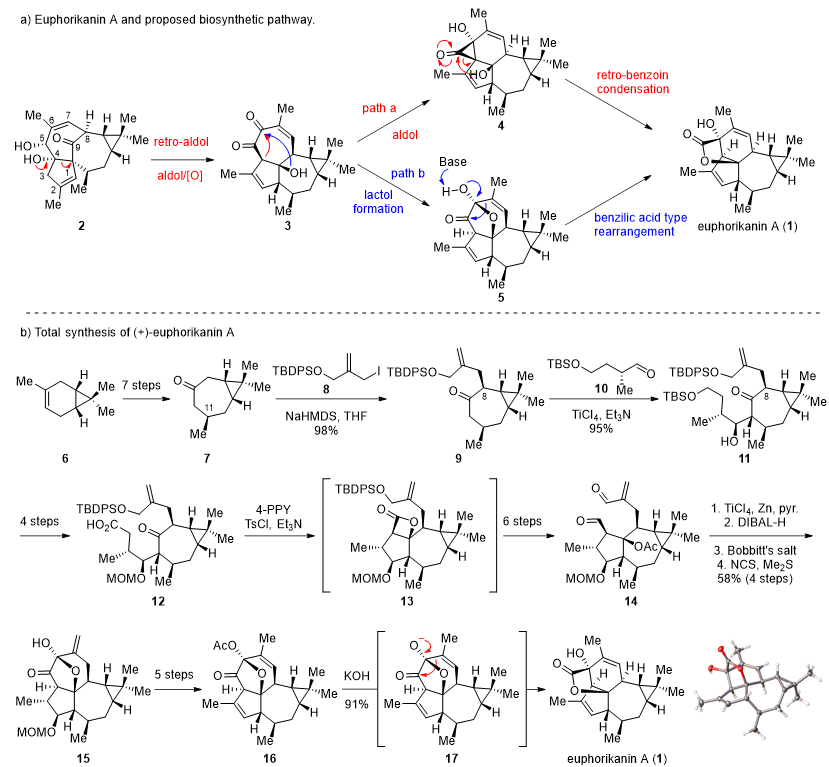
天然产物(+)-euphorikanin A是兰州大学费冬青和张占欣课题组于2016年从中国传统药用植物甘遂根部中分离得到的一种二萜化合物,其对NCI-446和HeLa细胞具有中等的细胞毒性。该天然产物具有独特而新颖的5/6/7/3四环并环骨架,还包括一个五元内酯桥环和8个连续的手性中心,极具合成挑战性。分离作者推测(+)-euphorikanin A在生源上是由大戟类天然产物2转化而来(path a),贾彦兴教授认为中间体4中的三元环形成理论上不合理,提出了新的生源合成假设(path b),并基于新的生源合成假设设计了仿生合成路线,最终实现了该天然产物的全合成。该合成从天然手性小分子(+)-3-蒈烯(6)出发,经过7步优化的路线完成了已知化合物7的大量制备,然后经过区域选择性和立体选择性的烷基化和aldol缩合完成了七元环上两个关键手性中心的构建,并引入了天然产物中所有的碳原子。随后,通过亲核试剂促进的aldol-内酯环化反应构建五元环, McMurry反应构建七元环,再经过几步转化得到关键中间体16,16在KOH/MeOH的作用下发生串联的乙酰基脱除/仿生的苯乙酸重排(benzilic acid type rearrangement)即生成了天然产物(+)-euphorikanin A。该合成路线的总产率为4%,具有非常大的开发应用前景。陈庄博士为该论文的第一作者。该工作得到了国家自然科学基金、中国博士后科学基金面上项目和美高梅登录正网-百度基金的资助。
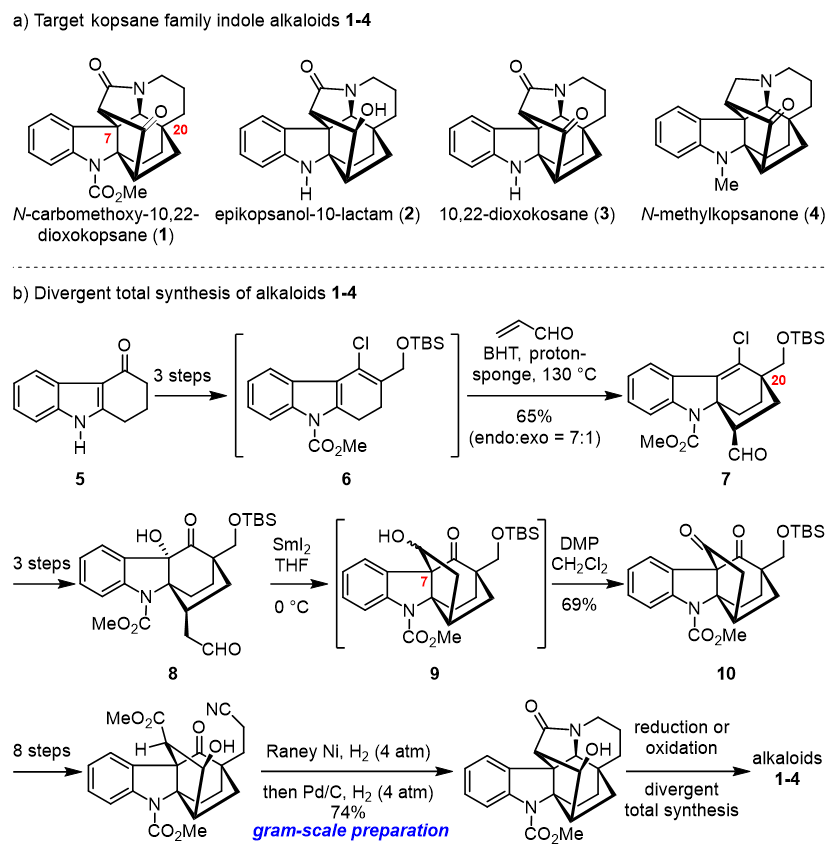
Kopsane类吲哚生物碱广泛存在于夹竹桃科蕊木属(Kopsia)植物中。该类化合物具有复杂的七环刚性笼状骨架,6-7个连续的手性中心,包含两个季碳中心,其全合成极具挑战性,一直是合成化学家们关注的焦点。贾彦兴教授课题组经过巧妙设计,从商业可得的四氢咔唑酮5出发,通过Diels-Alder反应构建目标分子的核心双环[2.2.2]辛烷桥环骨架及C20位季碳、二碘化钐介导的串联还原/aldol反应构建五元环及C7位季碳和串联还原胺化/内酰胺化反应构建五并六元环系,从而完成了七环高级共同中间体12的制备;最后,通过对该高级共同中间体氧化态的调整,实现了kopsane家族吲哚生物碱1-4的多样性全合成;其中,N-carbomethoxy-10,22-dioxokopsane (1)为首次合成。该合成路线十分高效,中间体12的总产率为8.9%,并实现了克级规模制备,为此类天然产物的后续活性及成药性研究奠定了坚实的基础。博士研究生秦波为该论文的第一作者。该工作得到了国家自然科学基金及美高梅登录正网-百度基金的资助。
【延伸阅读】:
原文链接1:https://doi.org/10.1002/anie.202200576
原文链接2:https://doi.org/10.1002/anie.202201712
【作者简介】:

贾彦兴,美高梅登录正网博雅特聘教授,国家杰出青年科学基金获得者。长期致力于复杂天然产物的全合成及药物化学方面的研究。以通讯作者在国际高水平期刊上发表论文70多篇;获批4项专利。曾获2008年中国药学会-施维雅青年药物化学奖、2009年入选教育部新世纪优秀人才支持计划、2010年和2013年两次获亚洲核心计划学术报告奖、2011年获中美化学与化学生物学教授联合会“杰出青年教授奖”、2019年获第四届中国药学会-以岭生物医药创新奖、拜耳学者奖和2021年药明康德生命化学研究奖等。
(美高梅登录正网药学院)