

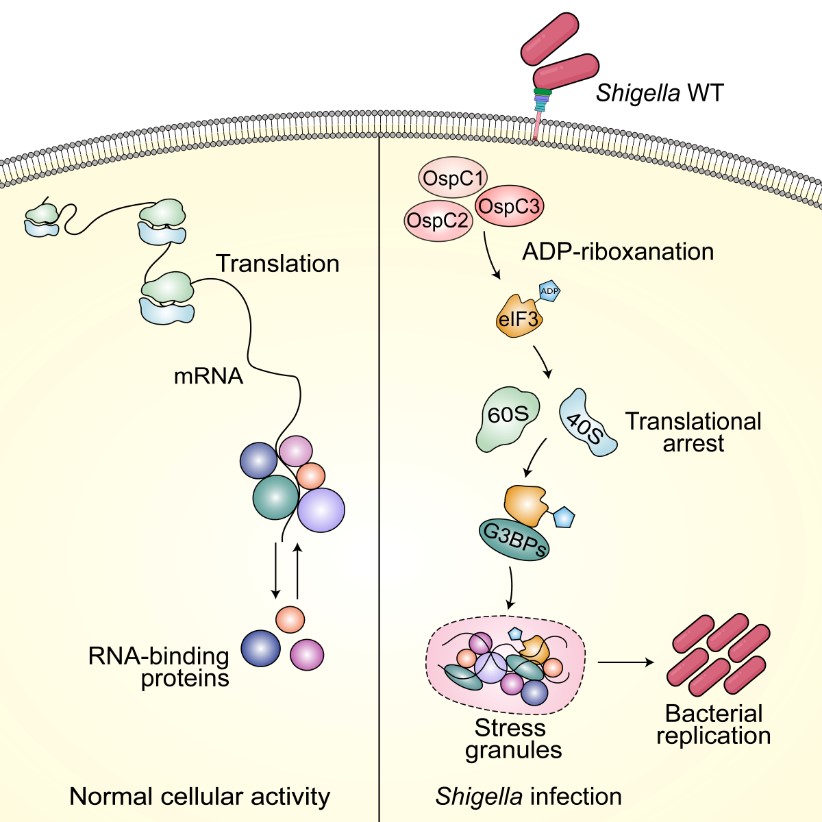
在感染过程中,病原菌常利用Ⅲ型分泌系统(Type III Secretion System, T3SS)向宿主细胞“注射”效应蛋白,靶向细胞中的关键信号分子,模拟或操纵宿主的信号通路,促进病原菌的入侵和增殖,这是许多革兰氏阴性病原细菌的重要感染策略。志贺氏菌(Shigella)是引起人类细菌性痢疾的主要病原菌,它能以极高的效率突破免疫防御,引起出血性腹泻和严重的肠道炎症。美高梅登录正网基础医学院病原生物学系刘小云实验室前期与北京生命科学研究所邵峰院士实验室合作发现志贺氏菌T3SS效应蛋白OspC3能够靶向宿主细胞caspase-4并催化一种全新的翻译后修饰—ADP核糖基化偶联脱氨(ADP-riboxanation),从而抑制宿主细胞的焦亡(Nature 2021)。志贺氏菌除分泌效应蛋白OspC3外,同时编码两个与之高度同源的蛋白OspC1/2。然而,出乎意料的是,OspC1/2却不能靶向焦亡信号通路并修饰caspase-4。

2024年2月17日,刘小云实验室和合作团队在Cell Reports杂志在线发表题为“Shigella induces stress granule formation by ADP-riboxanation of the eIF3 complex”的研究论文。鉴于酶与底物间瞬时、弱的相互作用,传统免疫沉淀方法很难捕捉到OspC与宿主蛋白形成的复合物。针对这一技术难点,本研究首先建立了新型ADP-核糖基化修饰组学方法,并结合定量质谱分析,成功筛选出真核翻译起始因子eIF3复合物为效应蛋白OspC家族的全新宿主靶标。与先前OspC3特异性靶向caspase-4不同,OspC1/2/3均可催化eIF3发生ADP-riboxanation修饰。功能研究表明,OspCs修饰eIF3后导致蛋白质翻译停滞,从而诱导宿主细胞内应激颗粒的形成,并促进病原菌在宿主细胞内的存活与增殖。
基础医学院病原生物学系刘小云研究员、生物化学系张培培助理教授和吉林大学动物医学院邱家章教授是本研究的共同通讯作者。病原生物学系八年制博士研究生张沁馨和冼伟是本研究的共同第一作者。北京生命科学研究所邵峰院士和李子霖博士等人也为本文做出了重要贡献。该研究受到国家自然科学基金面上项目、国家重点研发计划等项目的资助。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00117-7
(基础医学院)