

2020年10月27日,美高梅登录正网基础医学院王嘉东与基础医学院王巍、美高梅登录正网人民医院申占龙合作在学术期刊PNAS发表论文“KLHL22 maintains PD-1 homeostasis and prevents excessive T cell suppression”,报道了蛋白KLHL22维持PD-1蛋白水平稳态的机制以及5-FU对PD-1蛋白水平稳态的影响。该研究加深了目前对于PD-1蛋白相关调控的认识,也部分解释了5-FU与PD-1单抗联用效果更好的机制,为临床疗法的改进提供了参考。
近年来,PD-1相关免疫检查点抑制疗法在临床上取得了令人瞩目的成就,但是目前仍存在低响应率和耐药性等问题,限制了该疗法的进一步应用。这就要求我们对相关分子机制进行进一步的研究。与之相关的,PD-1相关治疗与放疗/化疗/靶向治疗联合使用为何会有更好疗效的机制仍不完全清楚,因此不利于现有治疗方案的改进与更多联用疗法的开发。目前人们已经知道PD-1的表达在细胞中受到多重调控。细胞膜表面的PD-1可以抑制效应T细胞的活性,PD-1的过量表达在肿瘤免疫逃逸中起关键作用;不过同时PD-1如果不能正常表达也可能会影响急性炎症的消退以及胸腺和外周的免疫耐受。因此,维持适当水平的PD-1表达具有重要意义。但细胞是如何在复杂的生理情况下维持细胞膜表面PD-1蛋白水平稳态,尤其是放化疗以及病理状态是否会破坏PD-1蛋白稳态维持,仍有待进一步研究。
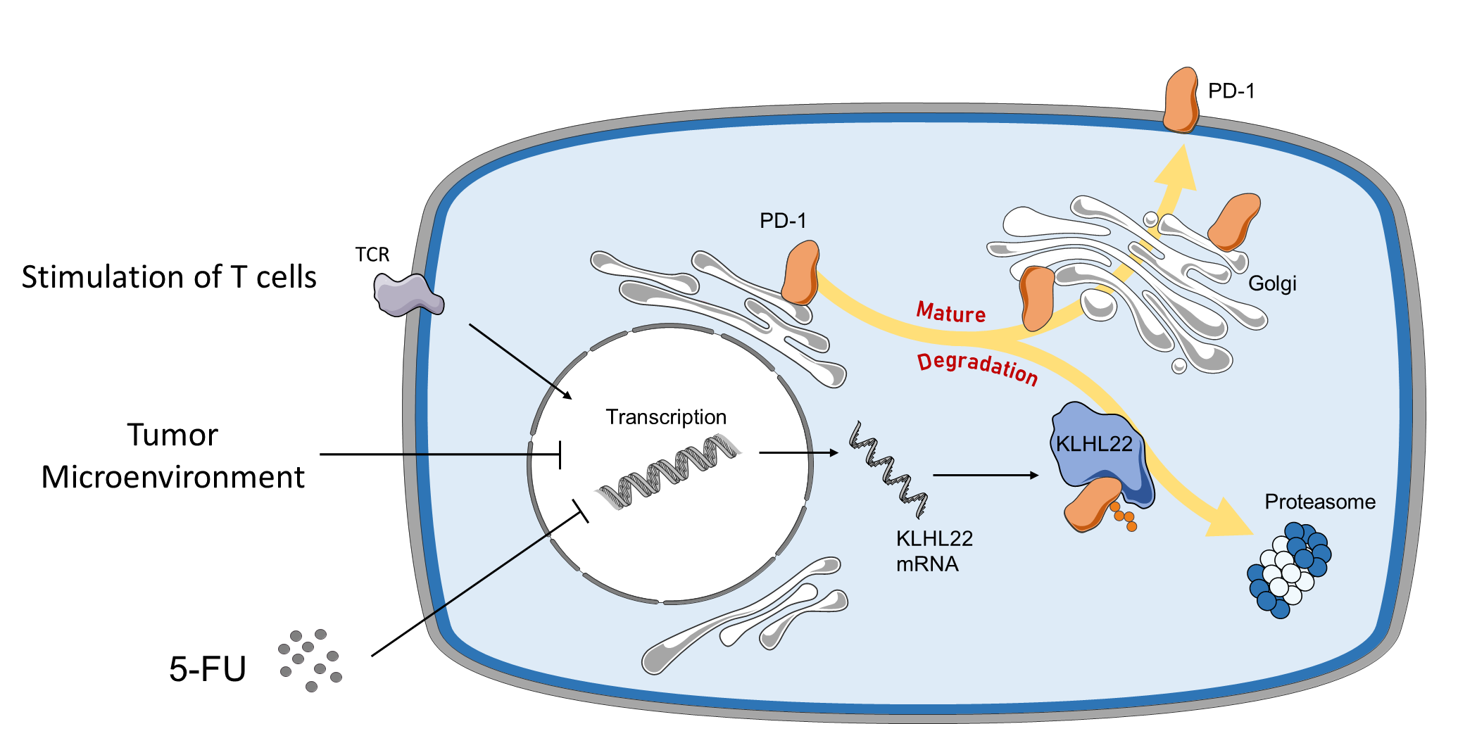
本研究报道了KLHL22可以降解未完全糖基化的PD-1,使其无法在细胞表面过度积聚,从而维持PD-1蛋白水平稳态,防止T细胞活性过度抑制。而在肿瘤微环境或5-FU治疗的情况下,KLHL22维持PD-1表达稳态机制的失效可能导致PD-1的过度积聚以及T细胞活性的降低。

在这项研究中,研究者首先进行了多次亲和纯化偶联质谱分析,通过比对实验结果找到并验证了KLHL22是与PD-1有着高亲和力的相互作用蛋白。并且进一步在细胞和小鼠模型中证明了KLHL22可以识别未完全糖基化的PD-1,并在PD-1转运到细胞表面之前介导其通过泛素蛋白酶体途径降解。由于KLHL22调控PD-1表达机制的特殊性,研究者推测其可以发挥维持PD-1蛋白水平稳态的作用,并进一步证明了在T细胞活化后,KLHL22被上调,从而控制细胞表面PD-1的表达量并将其蛋白水平保持在适当的范围内,维持PD-1蛋白水平的稳态,并防止T细胞的过度抑制。而在肿瘤微环境以及传统化疗药物5-FU的处理下,由于KLHL22介导的稳态维持机制的的缺失,过量的PD-1积累在细胞膜上,从而导致了T细胞活性的抑制。对来自临床病人的肿瘤浸润T细胞进行分析也与该机制相一致,因此提示5-FU与PD-1单抗联合治疗可能会取得协同效果,为进一步的临床试验提供了理论基础。
本文由王嘉东团队与王巍团队、申占龙团队合作完成,王嘉东团队2012级基础医学八年制学生周筱,2014级基础医学八年制学生周嘉栋以及申占龙团队2018级硕士研究生赵龙为共同第一作者。该工作得到了美高梅登录正网临床+X项目(PKU2018LCXQ01)、美高梅登录正网基础研究专项(BMU2019JC006)以及国家重点研发计划、国家自然科学基金、北京市自然科学基金的支持。
原文链接:https://doi.org/10.1073/pnas.2004570117