

作为生物体所必需的微量元素,铁离子参与了细胞的增殖、代谢和分化。尤其是近年来得到更多关注的铁死亡(Ferroptosis),更增强了研究人员对肿瘤细胞中铁离子代谢和转运机制的关注。和传统的凋亡(apoptosis)不同,依赖铁离子的细胞程序性死亡是一种全新的细胞死亡方式。细胞内氧自由基(ROS)调节失衡导致的脂质过氧化,是引发铁死亡的关键。至今,铁死亡已被发现与神经系统疾病、急性肾损伤等多种疾病相关,铁死亡影响肿瘤远端转移的研究,更将铁死亡的探索推到了风口浪尖。尽管目前已经发现多种氧化还原酶参与铁死亡的生物学过程,但是其关键调节因子---铁离子的代谢机制,目前尚未完全明晰。

2021年1月,美高梅登录正网基础医学院游富平研究员团队、吕丹研究员团队以及尹玉新教授团队在EMBO Reports在线发表题为”The deubiquitinase OTUD1 enhances iron transportation and potentiates host antitumor immunity”的成果,首次报道OTUD1作为铁离子转运的正调控因子,促进细胞内铁离子吸收、增强铁死亡敏感性,最终增强宿主抗肿瘤免疫应答(图1)。
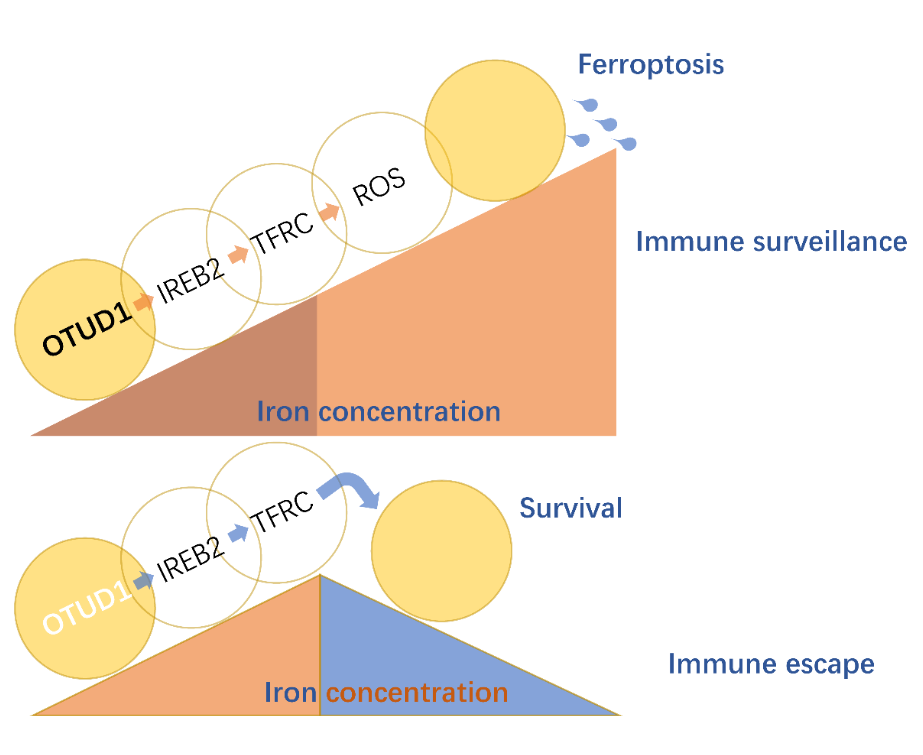
图1. OTUD1通过激活IREB2-TFRC信号通路,从而促进细胞内的铁离子浓度,提升细胞对铁死亡的敏感性,最终促进危险相关分子模式的释放和宿主免疫应答
这一研究,首次鉴定到抑癌基因OTUD1在肠癌组织中特异性下调表达。结合临床信息分析发现,OTUD1表达越低的肿瘤患者,其预后较差。有意思的是,尽管体外实验和裸鼠荷瘤实验显示,恢复细胞中OTUD1表达并不影响肿瘤的生长,但是在野生型小鼠体内,过表达OTUD1却可以显著抑制肿瘤的大小,明显延长荷瘤小鼠的生存时间,从而提示OTUD1可能参与宿主抗肿瘤免疫应答过程。研究显示,OTUD1的表达提高了肿瘤细胞中铁离子的浓度,促进肿瘤细胞中ROS的产生以及肿瘤微环境中CD8+ T细胞的浸润。在机制方面,OTUD1可以直接结合并促进铁反应元件结合蛋白2(IREB2)的去泛素化,从而抑制IREB2蛋白的降解,激活其下游基因TFRC的表达。作为人体内重要的转铁蛋白,TFRC的表达上调直接导致细胞内铁离子聚集、ROS水平增高以及细胞对铁死亡的敏感性的提升。和凋亡不同,本研究发现肿瘤细胞铁死亡可以释放多种危险相关分子模式(DAMPs),从而招募更多免疫细胞的浸润,最终提高宿主抗肿瘤免疫应答的能力(图2)。
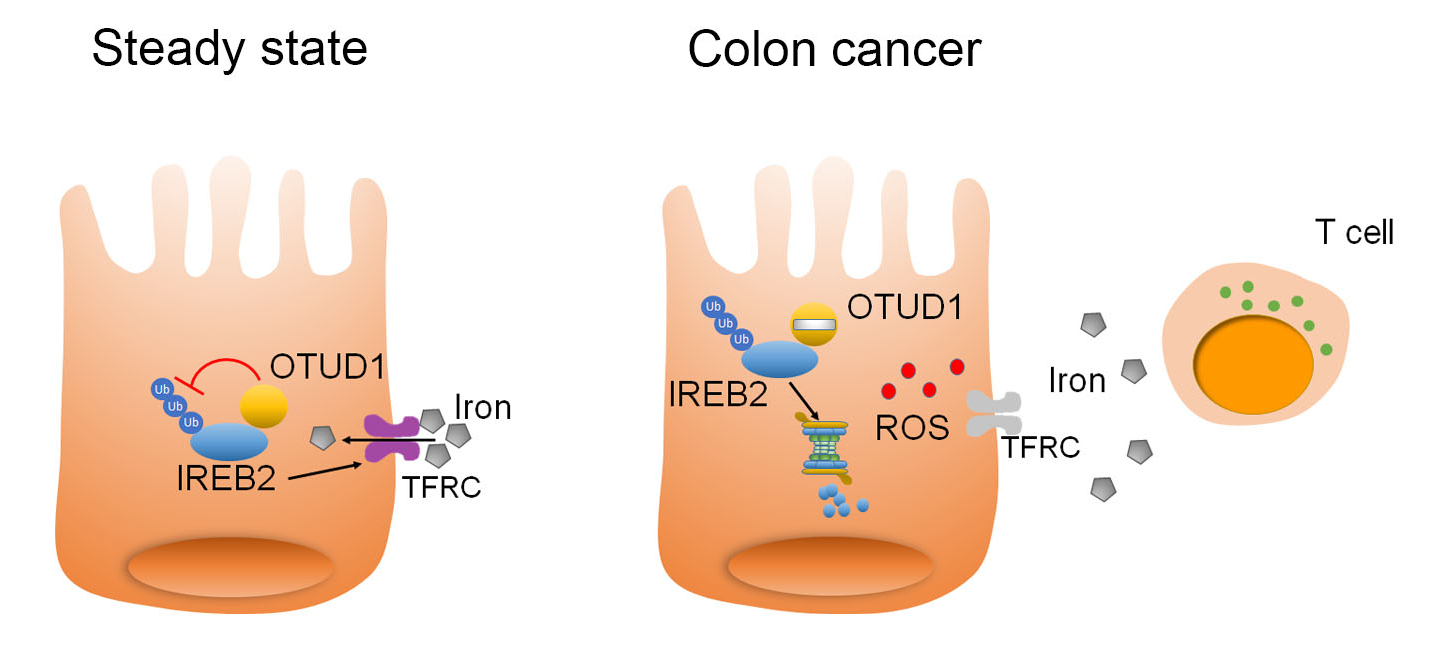
图2. 肿瘤细胞通过限制OTUD1的表达,增强IREB2泛素化水平,从而加快肿瘤中IREB2蛋白降解、抑制了细胞内铁离子的转运,最终阻止铁死亡的产生和T细胞的攻击
综上所述,本研究鉴定到具有调控铁离子代谢功能的OTUD1作为肿瘤中重要的免疫激活因子,通过诱导铁死亡,促进肿瘤细胞的免疫清除作用。本项研究为全面阐明肠癌细胞免疫逃逸过程提供了一种全新的机制,同时也为肠癌的免疫治疗提供了潜在的新型药物靶点。
美高梅登录正网基础医学院博士生宋佳和刘通通为该论文的共同第一作者,美高梅登录正网基础医学院游富平研究员、吕丹研究员和尹玉新教授为通讯作者。该项研究获得国家重点研发计划、国家自然科学基金、美高梅登录正网青年学者培养基金等项目的资助。
(美高梅登录正网基础医学院)